KIMIA:BAHAN BUATAN DALAM INDUSTRI
ASID SULFURIK
Asid sulfurik mempunyai pelbagai penggunaan dalam bidang industri


SILA TONTON VIDEO INI!


PROSES HABER
PERSAMAAN KIMIA:
 SILA TONTON VIDEO INI!
SILA TONTON VIDEO INI!
AKTIVITI MENYEDIAKAN BAJA AMMONIA SULFAT
ASID SULFURIK
Asid sulfurik mempunyai pelbagai penggunaan dalam bidang industri

PEMBUATAN ASID SULFURIK MELALUI PROSES SENTUH
Peringkat I: Penghasilan sulfur dioksida
Pembakaran serbuk sulfur dalam udara (gas oksigen) untuk menghasilkan gas sulfur dioksida.
Peringkat II: Penghasilan sulfur trioksida
Gas sulfur dioksida yang terhasil ditulenkan untuk menyingkirkan arsenik yang meracuni mangkin dalam tindak balas. Gas sulfur dioksida kemudiannya dipanaskan bersama-sama gas oksigen kering yang berlebihan. Pada suhu 450 °C – 500 °C dan tekanan 1 atmosfera, tindak balas berlaku dengan kehadiran mangkin vanadium (V) oksida, V2O5, untuk menghasilkan sulfur trioksida. Persamaan kimia bagi tindak balas yang berlaku adalah:
Dibawah keadaan tindak balas yang optimum ini, 98% sulfur trioksida dihasilkan. Sulfur dioksida yang tidak ditukarkan kepada sulfur trioksida dialir semula ke menara untuk bertindak balas.
Peringkat III: Penghasilan asid sulfurik
Sulfur trioksida yang terhasil dialir melalui asid sulfurik pekat untuk membentuk oleum, H2S2O7. Pencairan oleum dengan air menghasilkan asid sulfurik, H2SO4. Persamaan kimia bagi tindak balas yang berlaku adalah:
Platinum dan vanadium (V) oksida bertindak sebagai mangkin dalam Proses Sentuh. Vanadium (V) oksida lebih biasa digunakan daripada platinum walaupun vanadium (V) oksida kurang berkesan. Ini disebabkanvanadium (V) oksida lebih murah dan tidak mengalami keracunan arsenik.

SILA TONTON VIDEO INI!
Pencemaran Alam Sekitar Oleh Asid Sulfurik
፨Gas sulfur dioksida melarut dalam air hujan dan menghasilkan asid sulfurus .
፨Sulfur dioksida juga bertindak balas dengan oksigen di udara untuk menghasilkan sulfur trioksida.
፨Sulfur trioksida yang melarut dalam air hujan menghasilkan asid sulfurik.
፨Asid sulfurus dan asid sulfurik menyebabkan hujan asid dengan nilai pHnya lebih rendah daripada 5.6.
፨Hujan asid yang bersifat mengakis merosakkan bangunan yang berstruktur logam, berbatu marmar, atau konkrit.
፨Hujan asid yang mengalir ke dalam sungai, tasik, atau lautan akan menukarkan pH air dan menyebabkan kematian hidupan akuatik.
፨Hujan asid juga mengubah pH tanah dan menyebabkan kualiti tanaman terjejas.
፨Kita harus mengurangkan pembebasan gas sulfur dioksida ke atmosfera.
፨Selain itu, teknologi untuk menyingkirkan kandungan sulfur dalam bahan api fosil harus digalakkan.
AMMONIA


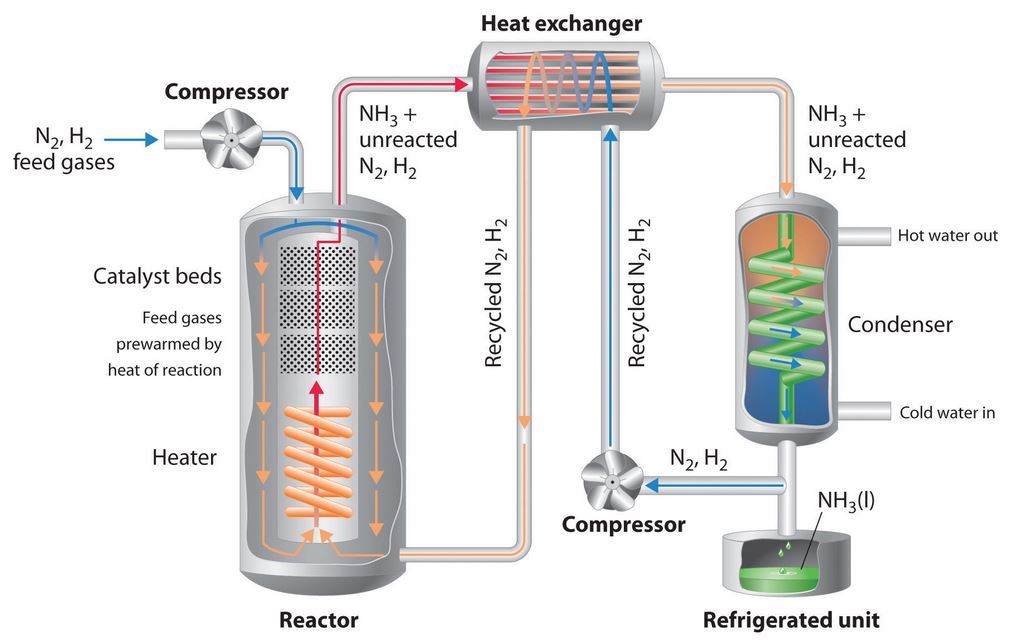
PROSES HABER

PROSES HABER UNTUK MENGHASILKAN AMMONIA
🍞Proses ini pada mulanya diciptakan oleh seorang ahli kimia yang hebat iaitu Fritz Haber, dan kemudiannya dikomersialkan oleh Carl Bosch.
🍞Kedua-dua bahan iaitu gas hidrogen dan nitrogen akan dicampurkan pada nisbah 1 : 3. Bermaksud 1 gas nitrogen bersamaan dengan 3 gas hidrogen. 

🍞Pada tangki Pemampatan (compressor), campuran tersebut akan dimampatkan pada 200atm. Kemudian dialirkan ke Reaktor. Pada Reaktor, campuran dipanaskan pada 450C dan besi digunakan sebagai mangkin bagi mempercepatkan tindakbalas
🍞Seterusnya campuran mengalir ke kebuk Penyejukan, di mana di sini, gas ammonia hasil daripada tindakbalas tadi akan ditukarkan kepada bentuk cecair. Cecair ammonia yang terhasil akan dikumpulkan. Manakala gas nitrogen dan gas hidrogen yang tidak bertindakbalas akan dikitar semula dan akan memulakan proses tersebut sekali lagi.

Tujuan: Menyediakan baja ammonium sulfat
| Bahan: » Kertas litmus merah » Larutan ammonia 2mol dm-3 » Asid sulfurik cair 1mol dm-3 » Air suling » Kertas turas Radas: » Bikar 100cm3 » Rod kaca » Tungku kaki tiga » Penunu Bunsen » Kasa dawai » Corong turas » Silinder penyukat » Mangkuk penyejat Prosedur:
|












ada pun haaaaa
ReplyDeletegood effort babal :)
baik doh..sapa buat ni memang boekk
ReplyDelete